Sciences Physiques › 5ème › Thème 5 : Ne restons pas de glace... › Fiche je sais je ne sais pas 5ème activité 5-1 et 5-2 › Correction de la fiche de 5ème activités 5-1 et 5-2
| Est-ce que je sais... | S'entrainer | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
…expliquer à l’échelle moléculaire les propriétés des gaz ? |
Si j’ouvre cette bouteille de parfum, très rapidement celui-ci va s’évaporer. Expliquez à l’échelle moléculaire pourquoi je finirai par en sentir l’odeur dans toute la pièce. Le parfum s’évapore. Il passe donc à l’état gazeux. Or les molécules d’un gaz se déplacent dans toutes les directions. Elles vont donc se répartir dans toute la pièce.
Expliquez, à l’échelle moléculaire pourquoi j’arrive à comprimer l’air contenu dans la seringue |
|||||||||||
|
…expliquez à l’échelle moléculaire les propriétés des liquides et des solides ? |
Pourquoi ne peut-on pas faire l’expérience précédente avec un solide ou un liquide ? Les solides ou les liquides sont incompressibles. Les molécules qui les constituent sont trop proches les unes des autres et peuvent difficilement être rapprochées davantage. Expliquez à l’échelle moléculaire pourquoi l’eau liquide épouse la forme du verre tandis que les glaçons gardent leur forme ?
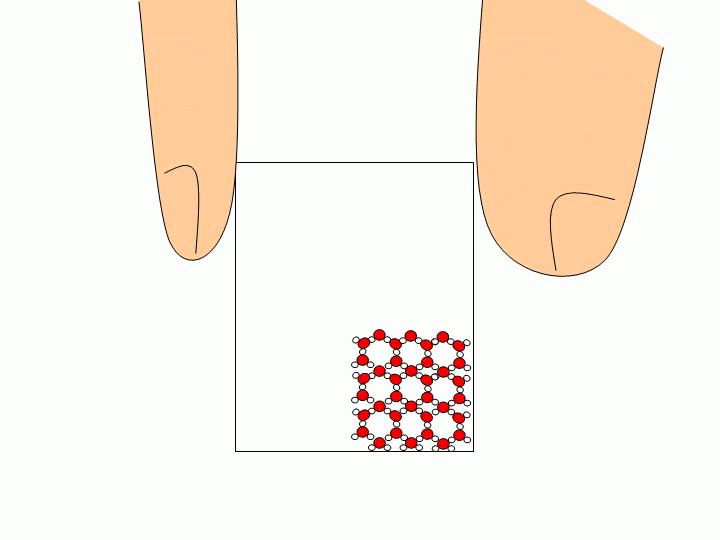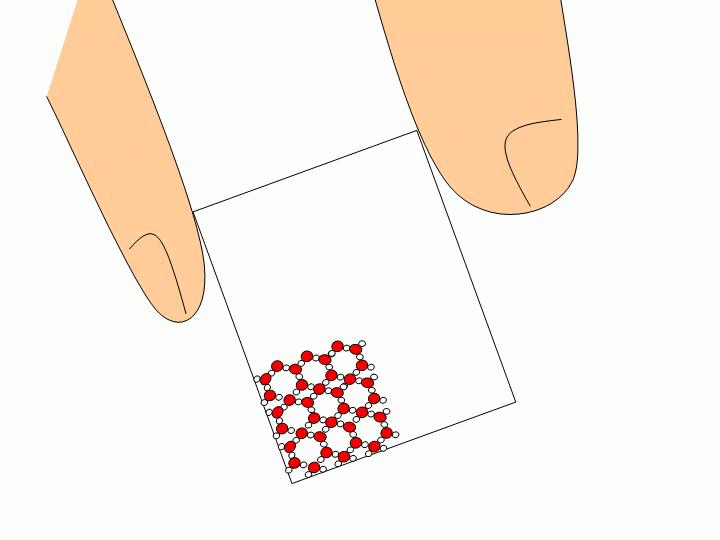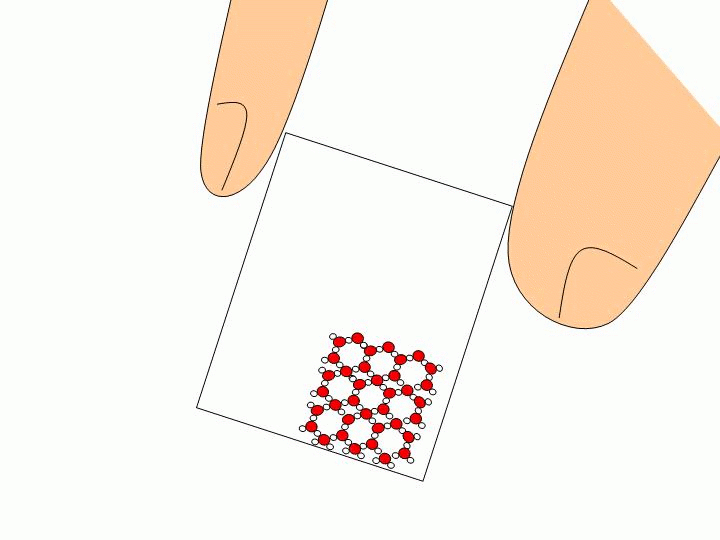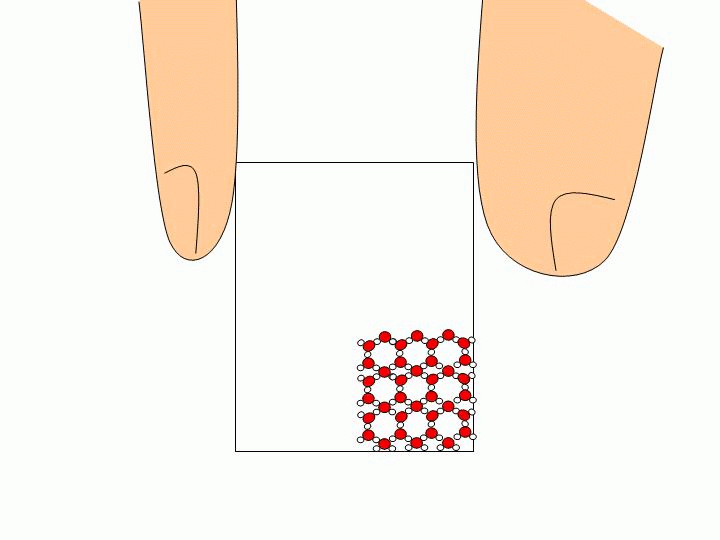 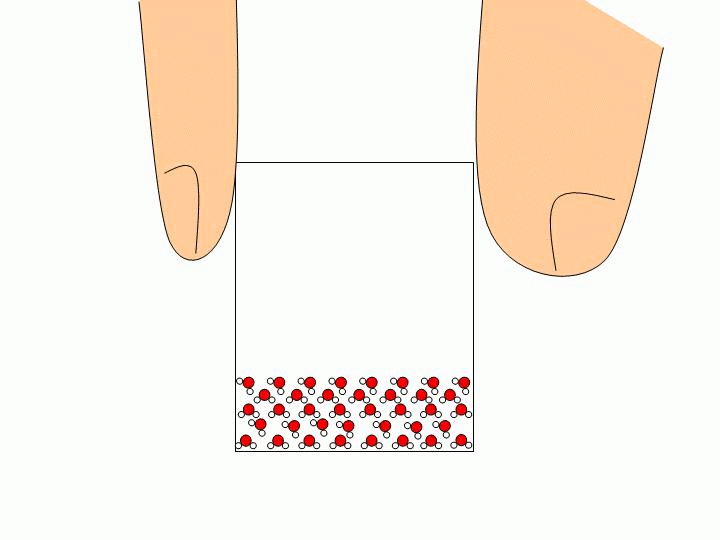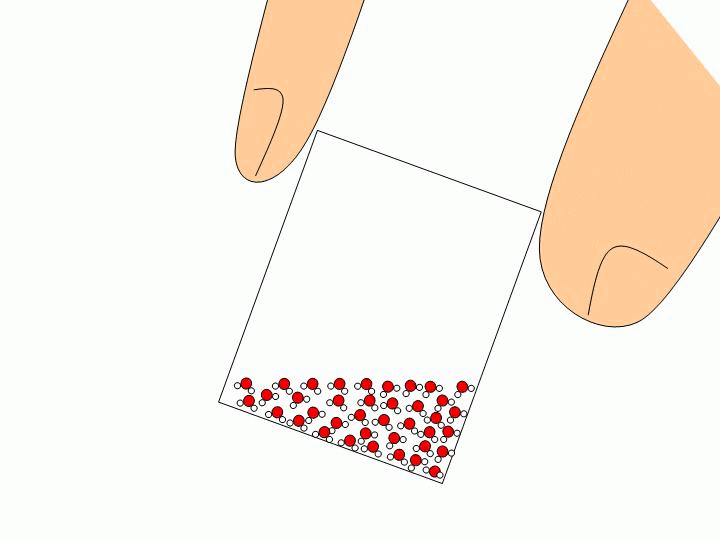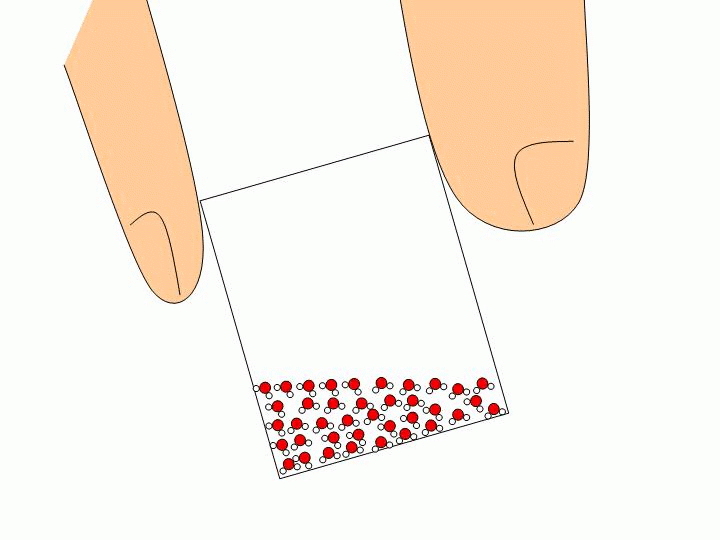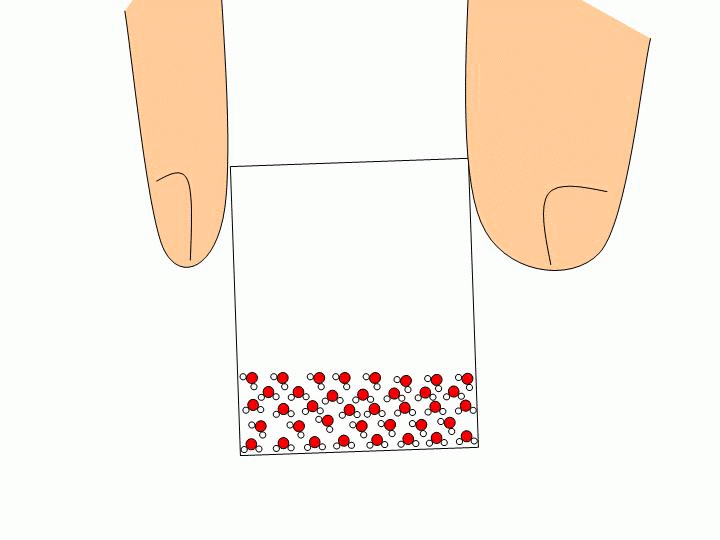 Les molécules d’un solide sont toutes liées entre elles. Elles ne se déplacent donc pas les unes par rapport aux autres. Un solide a donc une forme propre. Les molécules d’un liquide ne sont pas liées entre elles. Elles« glissent » donc les unes sur les autres ce qui permet au liquide de prendre la forme du récipient qui le contient. |
|
||||||||||
|
…quel est le nom des différents changements d’état de l’eau ? |
Ecrivez les noms des changements d’état correspondant sur les flèches du schéma ci-dessous 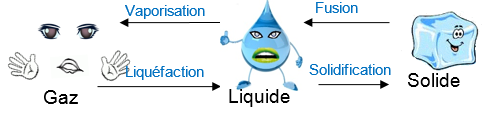
Remarque : la vaporisation peut se faire par ébullition (grosse bulles) ou par évaporation. |
|||||||||||
|
…comment évolue le volume au cours d’un changement d’état ? |
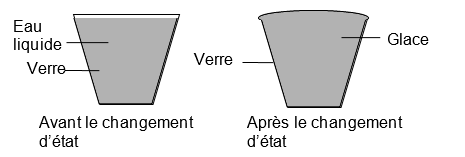
Voici le dessin du verre d’eau avant et après avoir été mis dans un congélateur.
Expliquez pourquoi le verre déborde-t-il après être sorti du congélateur. L’eau s’est solidifiée. Or au cours de la solidification de l’eau son volume augmente. Donc l’eau prend plus de place après le changement d’état et déborde du verre. |
|||||||||||
|
…comment évolue la masse au cours d’un changement d’état et justifier sa réponse à l’échelle moléculaire ? |
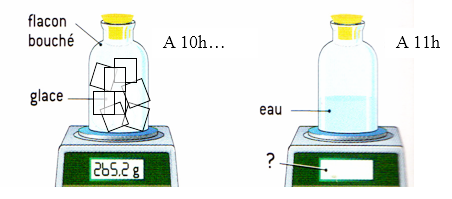
Entre 10h et 11h, on laisse des glaçons fondre dans un récipient. A 11h00, la balance va-t-elle indiquer une masse supérieure inférieure ou égale à 265,2g ? Justifiez votre réponse en discutant de molécules d’eau.>
Entre 10h00 et 11h00, l’eau a fondu. Or au cours d’un changement d’état, la masse de l’eau ne change pas. Donc la balance affiche toujours la même masse : 265,2g. En effet, le nombre de molécules reste le même. Seule leur disposition change. |
|||||||||||
|
…exploiter les résultats d’une expérience de changement d’état solide- liquide? |
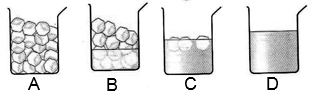
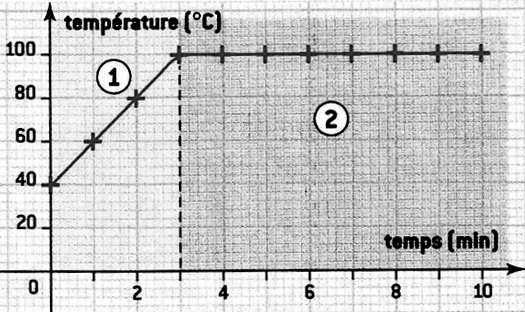
On laisse fondre de l’eau pure solide en relevant régulièrement la température. 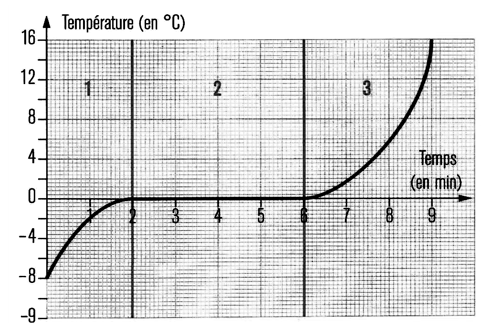 Donnez les temps de début et de fin du changement d’état ? Justifiez votre réponse. Lors d’un changement d’état la température ne change pas (palier de température). Or la température reste à Associez une région de la courbe à chaque dessin ci-dessous en justifiant votre réponse.
Au cours de la fusion, on observe de la glace et de l’eau liquide (dessins b et c). Or lors de la fusion d’une eau pure, la température se maintient à Si on observe uniquement de la glace (dessin a) alors la température est inférieure à Si on observe uniquement de l’eau liquide (dessin d) alors la température est supérieure à |
|||||||||||
|
…discuter des transferts d’énergie lors d’un changement d’état solide- liquide ? |
Expliquez vos réponses précédentes en discutant des énergies. Toute l’énergie transférée à la glace par le milieu extérieur a pour conséquence de la faire fondre. Lorsque l’eau est à l’état solide (région 1). L’énergie transférée à la glace par le milieu extérieur a pour conséquence d’augmenter sa température. Lorsque l’eau est à l’état liquide (dessin d) alors la température est supérieure à |
|||||||||||
|
…exploiter les résultats d’une expérience de changement d’état liquide- gaz? |
On fait chauffer de l’eau liquide. La température est prise toutes les minutes. Le graphique ci-dessous représente l’évolution de la température au cours du temps. A quel moment commence l’ébullition dans le graphique ci-dessus ? Dans la région 1, l’eau est principalement à l’état liquide. (Une évaporation a cependant lieu mais l’ébullition n’a pas commencé). L’ébullition commence au bout de 3min, lorsque le palier de température est atteint. Donnez la température de l’eau lors de l’ébullition. La température de l’eau est à 100°C lors de l’ébullition. |
|||||||||||
|
…discuter des transferts d’énergie lors d’un changement changements d’état liquide- gaz ? |
On augmente le chauffage de l’eau qui bout. Sa température va-t-elle changer ? Argumenter votre réponse en discutant des énergies. Au cours de l’ébullition, toute l’énergie apportée à l’eau sert à la faire changer d’état. Sa température ne change donc pas. Donc, si on augmente la température alors le changement d’état sera plus rapide mais la température de l’eau ne changera pas. |
|||||||||||